Que es agua:
es una sustancia cuya molécula está formada por dos átomos de hidrógeno y uno de oxígeno (H2O). Es esencial para la supervivencia de todas las formas conocidas de vida. El término agua, generalmente, se refiere a la sustancia en su estado líquido, pero la misma puede hallarse en su forma sólida llamada hielo, y en forma gaseosa denominada vapor. El agua cubre el 71% de la superficie de la corteza terrestre. Se localiza principalmente en los océanos donde se concentra el 96,5% del agua total, los glaciares y casquetes polares poseen el 1,74%, los depósitos subterráneos (acuíferos), los permafrost y los glaciares continentales suponen el 1,72% y el restante 0,04% se reparte en orden decreciente entre lagos, humedad del suelo, atmósfera, embalses, ríos y seres vivos. El agua es un elemento común del sistema solar, hecho confirmado en descubrimientos recientes. Puede ser encontrada, principalmente, en forma de hielo; de hecho, es el material base de los cometas y el vapor que compone sus colas.
Desde el punto de vista físico, el agua circula constantemente en un ciclo de evaporación o transpiración (evapotranspiración), precipitación, y desplazamiento hacia el mar. Los vientos transportan tanto vapor de agua como el que se vierte en los mares mediante su curso sobre la tierra, en una cantidad aproximada de 45.000 km³ al año. En tierra firme, la evaporación y transpiración contribuyen con 74.000 km³ anuales al causar precipitaciones de 119.000 km³ cada año.
Se estima que aproximadamente el 70% del agua dulce es usada para agricultura. El agua en la industria absorbe una media del 20% del consumo mundial, empleándose en tareas de refrigeración, transporte y como disolvente de una gran variedad de sustancias químicas. El consumo doméstico absorbe el 10% restante.
El agua es esencial para la mayoría de las formas de vida conocidas por el hombre, incluida la humana. El acceso al agua potable se ha incrementado durante las últimas décadas en la superficie terrestre. Sin embargo estudios de la FAO, estiman que uno de cada cinco países en vías de desarrollo tendrá problemas de escasez de agua antes de 2030; en esos países es vital un menor gasto de agua en la agricultura modernizando los sistemas de riego.
Tipos de agua
El agua se puede presentar en tres estados siendo una de las pocas sustancias que pueden encontrarse en sus tres estados de forma natural.[9] El agua adopta formas muy distintas sobre la tierra: como vapor de agua, conformando nubes en el aire; como agua marina, eventualmente en forma de icebergs en los océanos; en glaciares y ríos en las montañas, y en los acuíferos subterráneos su forma líquida. El agua puede disolver
muchas sustancias, dándoles diferentes sabores y olores. Como
consecuencia de su papel imprescindible para la vida, el ser humano
—entre otros muchos animales— ha desarrollado sentidos capaces de evaluar la potabilidad del agua, que evitan el consumo de agua salada o putrefacta.
Los humanos también suelen preferir el consumo de agua fría a la que
está tibia, puesto que el agua fría es menos propensa a contener microbios. El sabor perceptible en el agua de deshielo y el agua mineral se deriva de los minerales disueltos en ella; de hecho el agua pura es insípida. Para regular el consumo humano, se calcula la pureza del agua en función de la presencia de toxinas, agentes contaminantes y microorganismos. El agua recibe diversos nombres, según su forma y características:
El agua puede disolver
muchas sustancias, dándoles diferentes sabores y olores. Como
consecuencia de su papel imprescindible para la vida, el ser humano
—entre otros muchos animales— ha desarrollado sentidos capaces de evaluar la potabilidad del agua, que evitan el consumo de agua salada o putrefacta.
Los humanos también suelen preferir el consumo de agua fría a la que
está tibia, puesto que el agua fría es menos propensa a contener microbios. El sabor perceptible en el agua de deshielo y el agua mineral se deriva de los minerales disueltos en ella; de hecho el agua pura es insípida. Para regular el consumo humano, se calcula la pureza del agua en función de la presencia de toxinas, agentes contaminantes y microorganismos. El agua recibe diversos nombres, según su forma y características:Tipos de agua:
- Según su posición en el ciclo del agua:
- Hidrometeoro
- Precipitación
- Hidrometeoro
Precipitación según desplazamiento Precipitación según estado - precipitación vertical
- lluvia
- lluvia congelada
- llovizna
- lluvia helada
- nieve
- granizo blando
- gránulos de nieve
- perdigones de hielo
- aguanieve
- pedrisco
- cristal de hielo
- precipitación horizontal (asentada)
- rocío
- escarcha
- congelación atmosférica
- hielo glaseado
- precipitación líquida
- lluvia
- lluvia helada
- llovizna
- llovizna helada
- rocío
- precipitación sólida
- nevasca
- granizo blando
- gránulos de nieve
- perdigones de hielo
- lluvia helada
- granizo
- prismas de hielo
- escarcha
- congelación atmosférica
- hielo glaseado
- aguanieve
- precipitación mixta
- con temperaturas cercanas a los 0 °C
- precipitación vertical
- Partículas de agua en la atmósfera
- Partículas en suspensión
- nubes
- niebla
- bruma
- Partículas en ascenso (impulsadas por el viento)
- ventisca
- nieve revuelta
- Partículas en suspensión
- Según su circunstancia
- agua subterránea
- agua de deshielo
- agua meteórica
- agua inherente – la que forma parte de una roca
- agua fósil
- agua dulce
- agua superficial
- agua mineral – rica en minerales
- Agua salobre ligeramente salada
- agua muerta – extraño fenómeno que ocurre cuando una masa de agua dulce o ligeramente salada circula sobre una masa de agua más salada, mezclándose ligeramente. Son peligrosas para la navegación.
- agua de mar
- salmuera - de elevado contenido en sales, especialmente cloruro de sodio.
- Según sus usos
- agua entubada
- agua embotellada
- agua potable – la apropiada para el consumo humano, contiene un valor equilibrado de minerales que no son dañinos para la salud.
- agua purificada
– corregida en laboratorio o enriquecida con algún agente – Son aguas
que han sido tratadas para usos específicos en la ciencia o la
ingeniería. Lo habitual son tres tipos:
- agua destilada
- agua de doble destilación
- agua desionizada
- Atendiendo a otras propiedades
- agua blanda – pobre en minerales
- agua dura – de origen subterráneo, contiene un elevado valor mineral
- agua de cristalización — es la que se encuentra dentro de las redes cristalinas.
- hidratos — agua impregnada en otras sustancias químicas
- agua pesada – es un agua elaborada con átomos pesados de hidrógeno-deuterio. En estado natural, forma parte del agua normal en una concentración muy reducida. Se ha utilizado para la construcción de dispositivos nucleares, como reactores.
- agua de tritio
- agua negra
- aguas grises
- agua disfórica
- Según la microbiología
- agua potable
- agua residual
- agua lluvia o agua de superficie
El agua es también protagonista de numerosos ritos religiosos. Se sabe de infinidad de ceremonias ligadas al agua. El cristianismo, por ejemplo, ha atribuido tradicionalmente ciertas características al agua bendita. Existen también otros tipos de agua que después de cierto proceso adquieren supuestas propiedades, como el agua vitalizada.
Propiedades físicas y químicas
El agua es una sustancia que químicamente se formula como H2O; es decir, que una molécula de agua se compone de dos átomos de hidrógeno enlazados covalentemente a un átomo de oxígeno.
 Fue Henry Cavendish quien descubrió en 1781
que el agua es una sustancia compuesta y no un elemento, como se
pensaba desde la Antigüedad. Los resultados de dicho descubrimiento
fueron desarrollados por Antoine Laurent de Lavoisier dando a conocer que el agua estaba formada por oxígeno e hidrógeno. En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt demostraron que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
Fue Henry Cavendish quien descubrió en 1781
que el agua es una sustancia compuesta y no un elemento, como se
pensaba desde la Antigüedad. Los resultados de dicho descubrimiento
fueron desarrollados por Antoine Laurent de Lavoisier dando a conocer que el agua estaba formada por oxígeno e hidrógeno. En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt demostraron que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
Las propiedades fisicoquímicas más notables del agua son:
- El agua es insípida e inodora en condiciones normales de presión y temperatura. El color del agua varía según su estado: como líquido, puede parecer incolora en pequeñas cantidades, aunque en el espectrógrafo se prueba que tiene un ligero tono azul verdoso. El hielo también tiende al azul y en estado gaseoso (vapor de agua) es incolora.[
- El agua bloquea sólo ligeramente la radiación solar UV fuerte, permitiendo que las plantas acuáticas absorban su energía.

- Ya que el oxígeno tiene una electronegatividad superior a la del hidrógeno, el agua es una molécula polar. El oxígeno tiene una ligera carga negativa, mientras que los átomos de hidrógenos tienen una carga ligeramente positiva del que resulta un fuerte momento dipolar eléctrico. La interacción entre los diferentes dipolos eléctricos de una molécula causa una atracción en red que explica el elevado índice de tensión superficial del agua.
- La fuerza de interacción de la tensión superficial del agua es la fuerza de van der Waals entre moléculas de agua. La aparente elasticidad causada por la tensión superficial explica la formación de ondas capilares. A presión constante, el índice de tensión superficial del agua disminuye al aumentar su temperatura.
- También tiene un alto valor adhesivo gracias a su naturaleza polar.
- La capilaridad se refiere a la tendencia del agua de moverse por un tubo estrecho en contra de la fuerza de la gravedad. Esta propiedad es aprovechada por todas las plantas vasculares, como los árboles.
- Otra fuerza muy importante que refuerza la unión entre moléculas de agua es el enlace por puente de hidrógeno.
- El punto de ebullición del agua (y de cualquier otro líquido) está directamente relacionado con la presión atmosférica. Por ejemplo, en la cima del Everest, el agua hierve a unos 68º C, mientras que al nivel del mar este valor sube hasta 100º. Del mismo modo, el agua cercana a fuentes geotérmicas puede alcanzar temperaturas de cientos de grados centígrados y seguir siendo líquida. Su temperatura crítica es de 373,85 °C (647,14 K), su valor específico de fusión es de 0,334 kJ/g y su índice específico de vaporización es de 2,23kJ/g.
- El agua es un disolvente muy potente, al que se ha catalogado como el disolvente universal, y afecta a muchos tipos de sustancias distintas. Las sustancias que se mezclan y se disuelven bien en agua —como las sales, azúcares, ácidos, álcalis, y algunos gases (como el oxígeno o el dióxido de carbono, mediante carbonación)— son llamadas hidrófilas, mientras que las que no combinan bien con el agua —como lípidos y grasas— se denominan sustancias hidrofóbicas. Todos los componentes principales de las células de proteínas, ADN y polisacáridos se disuelven en agua. Puede formar un azeótropo con muchos otros disolventes.
- El agua es miscible con muchos líquidos, como el etanol, y en cualquier proporción, formando un líquido homogéneo. Por otra parte, los aceites son inmiscibles con el agua, y forman capas de variable densidad sobre la superficie del agua. Como cualquier gas, el vapor de agua es miscible completamente con el aire.
- El agua pura tiene una conductividad eléctrica relativamente baja, pero ese valor se incrementa significativamente con la disolución de una pequeña cantidad de material iónico, como el cloruro de sodio.
- El agua tiene el segundo índice más alto de capacidad calorífica específica —sólo por detrás del amoníaco— así como una elevada entalpía de vaporización (40,65 kJ mol-1); ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía.
- La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión. A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad (0,958 kg/l) a los 100 °C. Al bajar la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/l) y ese aumento es constante hasta llegar a los 3,8 °C donde alcanza una densidad de 1 kg/litro. Esa temperatura (3,8 °C) representa un punto de inflexión y es cuando alcanza su máxima densidad (a la presión mencionada). A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente (casi nada en la práctica), hasta que a los 0 °C disminuye hasta 0,9999 kg/litro. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/l a 0,917 kg/l.

- El agua puede descomponerse en partículas de hidrógeno y oxígeno mediante electrólisis.
- Como un óxido de hidrógeno, el agua se forma cuando el hidrógeno —o un compuesto conteniendo hidrógeno— se quema o reacciona con oxígeno —o un compuesto de oxígeno—. El agua no es combustible, puesto que es un producto residual de la combustión del hidrógeno. La energía requerida para separar el agua en sus dos componentes mediante electrólisis es superior a la energía desprendida por la recombinación de hidrógeno y oxígeno. Esto hace que el agua, en contra de lo que sostienen algunos rumores, no sea una fuente de energía eficaz.
- Los elementos que tienen mayor electropositividad que el hidrógeno —como el litio, el sodio, el calcio, el potasio y el cesio— desplazan el hidrógeno del agua, formando hidróxidos. Dada su naturaleza de gas inflamable, el hidrógeno liberado es peligroso y la reacción del agua combinada con los más electropositivos de estos elementos es una violenta explosión.
El agua en la Tierra
El agua es fundamental para todas las formas de vida conocida. Los humanos consumen agua potable. Los recursos naturales se han vuelto escasos con la creciente población mundial y su disposición en varias regiones habitadas es la preocupación de muchas organizaciones gubernamentales.
PARA UNA MEJO INFORMACIÓN PRESIONE CLIC AQUÍ




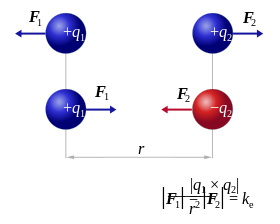

 y
y  duplica su magnitud si alguna de las cargas dobla su valor, la triplica
si alguna de las cargas aumenta su valor en un factor de tres, y así
sucesivamente. Concluyó entonces que el valor de la fuerza era
proporcional al producto de las cargas:
duplica su magnitud si alguna de las cargas dobla su valor, la triplica
si alguna de las cargas aumenta su valor en un factor de tres, y así
sucesivamente. Concluyó entonces que el valor de la fuerza era
proporcional al producto de las cargas:


 ,
al duplicarla, la fuerza de interacción disminuye en un factor de 4
(2²); al triplicarla, disminuye en un factor de 9 (3²) y al cuadriplicar
,
al duplicarla, la fuerza de interacción disminuye en un factor de 4
(2²); al triplicarla, disminuye en un factor de 9 (3²) y al cuadriplicar


 se expresa como:
se expresa como:


 es un vector unitario, siendo su dirección desde la cargas que produce la fuerza hacia la carga que la experimenta.
es un vector unitario, siendo su dirección desde la cargas que produce la fuerza hacia la carga que la experimenta. , entonces
, entonces  .
. y
y  .
La ley de Coulomb es una ecuación vectorial e incluye el hecho de que
la fuerza actúa a lo largo de la línea de unión entre las cargas.
.
La ley de Coulomb es una ecuación vectorial e incluye el hecho de que
la fuerza actúa a lo largo de la línea de unión entre las cargas.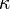 es la Constante de Coulomb y su valor para unidades SI es
es la Constante de Coulomb y su valor para unidades SI es  Nm²/C².
Nm²/C². donde
donde  es la permitividad relativa,
es la permitividad relativa,  , y
, y  F/m es la permitividad del medio en el vacío.
F/m es la permitividad del medio en el vacío.
 y su resultado será en sistema MKS (
y su resultado será en sistema MKS ( ). En cambio, si la unidad de las cargas están en UES (q), la constante se expresa de la siguiente forma
). En cambio, si la unidad de las cargas están en UES (q), la constante se expresa de la siguiente forma  y su resultado estará en las unidades CGS (
y su resultado estará en las unidades CGS ( ).
). tal que la fuerza dada por la ley de Coulomb sea expresable como:
tal que la fuerza dada por la ley de Coulomb sea expresable como:

 , es el vector posición genérico de un punto donde se pretende definir el potencial de Coulomb y
, es el vector posición genérico de un punto donde se pretende definir el potencial de Coulomb y , es el vector de posición de la carga eléctrica
, es el vector de posición de la carga eléctrica  cuyo campo pretende caracterizarse por medio del potencia
cuyo campo pretende caracterizarse por medio del potencia
 . En el equilibrio:
. En el equilibrio:


 la separación de equilibrio entre las esferas cargadas, la fuerza
la separación de equilibrio entre las esferas cargadas, la fuerza  y, por lo tanto, se cumple la siguiente igualdad:
y, por lo tanto, se cumple la siguiente igualdad:
 y la fuerza de repulsíón entre las mismas estará dada por:
y la fuerza de repulsíón entre las mismas estará dada por:
 . Y de modo similar se obtiene:
. Y de modo similar se obtiene:
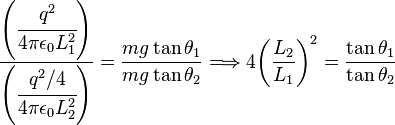
 y
y  y las separaciones entre las cargas
y las separaciones entre las cargas  es posible verificar que la igualdad se cumple dentro del error
experimental. En la práctica, los ángulos pueden resultar difíciles de
medir, así que si la longitud de los hilos que sostienen las esferas son
lo suficientemente largos, los ángulos resultarán lo bastante pequeños
como para hacer la siguiente aproximación:
es posible verificar que la igualdad se cumple dentro del error
experimental. En la práctica, los ángulos pueden resultar difíciles de
medir, así que si la longitud de los hilos que sostienen las esferas son
lo suficientemente largos, los ángulos resultarán lo bastante pequeños
como para hacer la siguiente aproximación: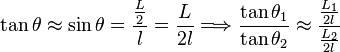

![\frac{L_1}{L_2}\approx 4 {\left ( \frac {L_2}{L_1} \right ) }^2\Longrightarrow \frac{L_1}{L_2}\approx\sqrt[3]{4} \,\!](http://upload.wikimedia.org/wikipedia/es/math/7/c/e/7cef359a7cd4a5f6a3be9d150a4a14e0.png)

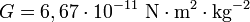 la constante de gravitación universal,
la constante de gravitación universal, las masas de los cuerpos en cuestión y
las masas de los cuerpos en cuestión y la distancia entre los centros de las masas.
la distancia entre los centros de las masas. y
y  respectivamente y sus masas son
respectivamente y sus masas son  y
y  . Sustituyendo los datos:
. Sustituyendo los datos:
 .
.